Bioteknologi
Hewan
I.
Pengertian
Bioteknologi Hewan
Bioteknologi
hewan adalah penerapan prinsip-prinsip ilmiah dan rekayasa untuk memodifikasi
mahluk hidup untuk membuat produk, memperbaiki hewan, dan mengembangkan
mikroorganisme untuk penggunaan tertentu (Miguel, 2010). Bioteknologi hewan pada awalnya dilakukan secara tradisional
dengan cara menyilangkan hewan dan selective breeding. Praktek ini terbukti
telah dapat memperbaiki kualitas hewan-hewan untuk keperluan tertentu contohnya
yan popular dan persilangan keturunan yang disebut bagal (mule), sedangkan persilangan resiprok atau kebalikannya
antara kuda jantan dengan keledai betina akan menghasilkan keturunan yang
disbeut hinnie. Baik bagal maupun
Hinnie digunakan sebagai hewan pekerja yang cukup tangguh dan bermanfaat. Praktek persilangan
keledai sampai sekarang masih banyak dilakukan seperti yang dilaporkan oleh Krugel et al. (2008) di
banyak negara di Eropa. Contoh lainnya adalah pemuliaan ikan nila (Oreochromis
niloticus) dengan menggunakan teknik selective breeding. Program ini bertujuan
untuk meningkatkan konsumsi protein pada masyarakat miskin di negara
berkembang. Ikan hasil pemuliaan ini dikenal dengan nama ikan nila GIFT (Genetic
Improvement of Formed Tilapia).
Ada
beberapa alasan melakukan bioteknologi hewan diantaranya untuk mengisolasi,
identifikasi dan karakterisasi gen agan dapat mempelajari fungsinya, untuk
membantu menyiapkan model penelitian tentang penyakit, dan mengembangkan obat
dan strategi bagi penyembukhan penyakit (misalnya melalui terapi gen), untuk
menyiapkan jaringan/organ untuk transplantasi, untuk menghasilkan susu yang
mengandung bahan terapi, susu dengan kandungan nutrisi yang baik bagi
pertumbuhan dan perkembangan balita dan anak-anak, dan untuk meningkatkan
kualitas ternak (Sutomo, 2016).
II.
Kloning dan Transgenik
Kloning
dan transgenik seringkali diartikan sama atau dicampur adukkan pengertiannya
walaupun sebenarnya keduanya memiliki arti yang berbeda. Kloning adalah proses menghasilkan
individu-individu yang secara genetik sama dan individu yang dihasilkan dengan
cara kloning disebut sebagai klon. Hewan transgenik dihasilkan dengan cara
menyisipkan gen baru dengan bantuan manusia. Hewan transgenik bisa dibuat
dengan teknologi cloning. Namun demikian, suatu hewan bisa merupakan suatu klon
tapi bukan transgenic atau bisa juga suatu hewan adalah transgenik tapi bukan
merupakan suatu klon (Wall et al., 2009).
III.
Contoh-Contoh
Hewan Kloning
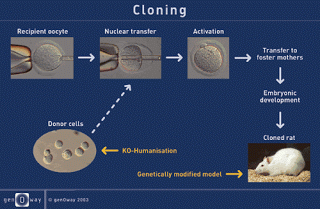
a. Transfer
Nukleus
 |
|
Transfer nukleus membutuhkan dua sel yaitu suatu sel
donor dan suatu oosit atau sel telur. Telur matur sebelum dibuahi dibuang
intinya atau nukleusnya. Proses pembuangan nukleus tadi dinamakan enukleasi.
Hal ini dilakukan untuk menghilangkan informasi genetisnya. Ke dalam telur yang
telah dienukleasi tadi kemudian dimasukkan nukleus (donor) dari sel somatik.
Penelitian membuktikan bahwa sel telur akan berfungsi terbaik bila ianya dalam
anfertilisasi, sebab hal ini akan mempermudah penerimaan nukleus donor seperti
dirinya sendiri. Di dalam telur, inti sel donor tadi akan bertindak sebagai
inti sel zigot dan membelah serta berkembang menjadi blastosit. Blastosit
selanjutnya ditransfer ke dalam uterus induk pengganti (surrogate mother). Jika
seluruh proses tadi berjalan baik, suatu replika yang sempurna dari donor akan
lahir. Jadi sebenarnya setelah terbentuk blastosit in vitro, proses selanjutnya
sama dengan proses bayi tabung yang tehnologinya telah dikuasai oleh para ahli
Obstetri Ginekologi (Thomas, 2001)
Kloning domba
Dolly merupakan peristiwa penting dalam sejarah kloning. Tidak saja hal
tersebut membangkitkan antusias terhadap kloning, melainkan juga hal tersebut
membuktikan bahwa kloning binatang dewasa dapat disempurnakan. Sebelumnya,
tidak diketahui bahwa suatu nukleus dewasa ternyata mampu memproduksi suatu
hewan yang komplit. Bila terjadi kerusakan genetis dan deaktivasi gen yang
sederhana maka kedua keadaan tersebut kemungkinan bersifat menetap. Hal tersebut di atas bukanlah suatu
kasus yang menyusul setelah penemuan oleh Ian Wilmut dan Keith Cambell tentang
suatu metode yang mana mampu melakukan singkronisasi siklus sel dari kedua sel
donor dan sel telur. Tanpa singkronosasi siklus sel, maka inti tidak akan
berada pada suatu keadaan yang optimum untuk dapat diterima oleh embrio.
Bagaimanapun juga sel donor harus berjuang untuk dapat masuk ke Gap Zero, atau
stadium sel GO, atau stadium sel dorman (Thomas, 2001).
Pertama, suatu sel (sel donor) diseleksi dari sel
kelenjar mammae domba betina berbulu putih (Finn Dorset) untuk menyediakan
informasi genetis bagi pengklonan. Untuk studi ini, peneliti membiarkan sel
membelah dan membentuk jaringan in vitro atau diluar tubuh hewan. Hal ini akan
menghasilkan duplikat yang banyak dari suatu inti yang sama. Tahap ini hanya
akan bermanfaat bila DNA nya diubah, seperti pada kasus Dolly, karena perubahan
tersebut dapat diteliti untuk memastikan bahwa mereka telah dipengaruhi
(Thomas, 2001).
Suatu sel donor diambil dari jaringan dan dimasukkan
ke dalan campuran, yang hanya memiliki nutrisi yang cukup untuk mempertahankan
kehidupan sel. Hal ini menyebabkan sel untuk menghentikan seluruh gen yang
aktif dan memasuki stadium GO. Kemudian sel telur dari domba betina Blackface
(domba betina yang mukanya berbulu hitam = Scottish Blackface) dienokulasi dan
diletakkan disebelah sel donor.
Satu sampai delapan jam setelah pengambilan sel
telur, kejutan listrik digunakan untuk menggabungkan dua sel tadi, pada saat
yang sama pertumbuhan dari suatu embrio mulai diaktifkan. Teknik ini tidaklah
sepenuhnya sama seperti aktivasi yang dilakukan oleh sperma, karena hanya
beberapa sel yang diaktifkan oleh kejutan listrik yang mampu bertahan cukup
lama untuk menghasilkan suatu embrio.
Jika embrio ini dapat bertahan, ia dibiarkan tumbuh
selama sekitar enam hari, diinkubasi di dalam oviduk domba. Ternyata sel yang diletakkan di dalam oviduk lebih awal, di dalam
pertumbuhannya lebih mampu bertahan dibandingkan dengan yang diinkubasi di
dalam laboratorium. Akhirnya embrio tadi ditempatkan ke dalam uterus betina
penerima (surrogate mother). Induk betina tersebut selanjutnya akan mengandung
hasil cloning tadi hingga ianya siap untuk dilahirkan. Bila tidak terjadi
kekeliruan, suatu duplikat yang persis sama dari donor akan lahir.
Domba yang baru lahir tersebut memiliki semua
karakteristik yang sama dengan domba yang lahir secara alamiah. Dan telah
diamati bila ada efek yang merugikan, seperti resiko yang tinggi terhadap
kanker atau penyakit genetis lainnya yang terjadi atas kerusakan bertahap
kepada DNA, dikemudian hari juga terjadi pada Dolly atau hewan lainnya yang
dikloning dengan metode ini.
Kata kloning, berasal dari bahasa Inggris clone, pertama kali diusulkan oleh
Herbert Webber pada tahun 1903 untuk mengistilahkan sekelompok organisme hewan maupun
tumbuh-tumbuhan yang dihasilkan melalui reproduksi aseksual dan berasal dari
satu induk yang sama. Setiap anggota dari klon tersebut mempunyai susunan dan
jumlah gen yang sama dan kemungkinan besar fenotipnya juga sama. Kloning pada
hewan dilakukan mula-mula pada amfibi (kodok), dengan mengadakan transplantasi
nukleus ke dalam telur kodok yang dienukleasi. Sebagai donor digunakan nukleus
sel somatik dari berbagai stadium perkembangan. Ternyata donor nukleus dari sel
somatik yang diambil dari sel epitel usus kecebong pun masih dapat membentuk
embrio normal (Thomas, 2001).
Sejak Wilmut
berhasil membuat klon anak domba yang donor nukleusnya diambil dari sel
kelenjar susu domba dewasa, maka terbukti bahwa pada mammalia pun klon dapat
dibuat. Atas dasar itu para ahli berpendapat bahwa pada manusia pun secara
teknis klon dapat dibuat.
Pada Juli 1998, suatu tim ilmuwan dari Universitas
Hawai mengumumkan bahwa mereka telah menghasilkan tiga generasi tikus kloning
yang secara genetik identik. Tehnik ini diakreditasi atas nama Teruhiko
Wakayama dan Ryuzo Yanagimachi dari Universitas Hawai. Tikus telah sejak lama
diketahui merupakan mamalia yang tersulit untuk dikloning, ini merujuk pada,
bahwa segera setelah suatu sel telur tikus mengalami fertilisasi ia akan segera
membelah. Domba digunakan karena sel telurnya membutuhkan beberapa jam sebelum
membelah, memungkinkan adanya waktu bagi sel telur untuk memprogram ulang
nukleus barunya. Meskipun tidak mendapatkan keuntungan tersebut ternyata
Wakayama dan Yanagimachi mampu melakukan kloning dengan angka keberhasilan yang
jauh lebih tinggi (3 kloning dari sekitar seratus yang dilakukan) dibandingkan
Ian Wilmut (satu dari 277).
Sel telur tikus yang tidak dibuahi digunakan sebagai
resipien dari inti donor. Setelah dienokulasi, sel telur memiliki inti donor
yang dimasukkan ke dalamnya. Nukleus donor diambil dari sel-sel dalam hitungan
menit dari setiap ekstrak sel dari tikus tersebut. Tidak seperti pada proses
yang digunakan untuk melahirkan Dolly, tanpa in vitro atau di luar dari tubuh hewan,
kultur dilakukan justru pada sel-sel tersebut. Setelah satu jam sel-sel telah
menerima nukleus-nukleus yang baru. Setelah penambahan waktu selama 5 jam sel
telur kemudian ditempatkan pada suatu kultur kimia untuk memberi kesempatan
sel-sel tersebut tumbuh, sebagaimana layaknya fertilisasi secara alamiah.
IV.
Contoh Hewan
Transgenik
a.
Glow fish – Ikan
Bercahaya
Glow fish merupakan salah satu contoh hewan
transgenik yang direkayasa secara genetiknya. Ikan ini dikembagkan dari Amerika
Serikat yang merekayasa DNA dari ikan zebra (Danio rerio) dengan gen pengkode
protein flourens warna hijau dari gfp (green flourescent protein). Namun secara
fenotip, warna yang dihasilkan bukan hanya warna hijau saja melainkan warna
kuning hingga merah. (Hossein, 2009).
b.
Sapi Transgenik
Penghasil Protein Susu
Rekombinan Teknologi transgenik ini telah sukses
dilakukan untuk kepentingan di bidang agrikultur dalam meningkatkan mutu
kualitas pangan. Pada hewan uji yang berupa lembu jarang sekali dilakukan
percobaan transgenik hal ini dikarenakan banyak kendala seperti masa
regenerasinya butuh waktu sekitar 2 tahun. Namun para peneliti akhirnya bisa
menyisipi gen penghasil α-lactalbumin yang berasal dari manusia. Dari hasil uji
produksi susu sebesar 91 ml, ditemukan sekresi α–lactalbumin dengan konsentrasi
2,4 mg ml-1. Metode yang digunakan
adalah melakukan fertilisasi secara in vitro yang selanjutnya akan dihasilkan
zigot. Tahap berikutnya zigot akan diinjeksi dengan DNA yang mengandung gen
α–lactalbumin. Proses injeksi dengan menggunkan teknik microinjection.
Selanjutnya zigot dikultur selama 6 atau 7 hari dengan menggunakan media
sintetik yang menyerupai cairan oviduk. Setelah itu akan tumbuh menjadi embrio
dan ditransfer ke rahim lembu untuk proses kehamilan (Hossein, 2009).
c.
Kucing Yang
Bersinar Dalam Gelap
Pada tahun 2007, ilmuwan Korea Selatan mengubah DNA
seekor kucing untuk membuat kucing tersebut bersinar di dalam gelap dan
kemudian mereka mengambil DNA tersebut dan menggunakannya untuk meng-clone
kucing-kucing lain—menciptakan sekelompok kucing yang berbulu halus, yang
bersinar dalam gelap. Beginilah cara mereka melakukannya: Para peneliti
mengambil sel-sel kulit dari beberapa ekor kucing Angora Turki berjenis kelamin
betina dan menggunakan sebuah virus untuk memasukkan instruksi-instruksi
genetik untuk menciptakan protein yang bisa menimbulkan cahaya yang berwarna
merah. Kemudian mereka meletakkan nuclei yang gen-nya sudah diubah tersebut ke
dalam sel telur untuk melakukan cloning, dan embrio-embrio yang sudah di-clone
tersebut diimplantasikan kembali pada kucing-kucing donor tersebut—sehingga
membuat kucing-kucing tersebut menjadi ibu pengganti bagi clones mereka sendiri
(Hossein, 2009).
d.
Enviropig
Enviropig or “Frankenswine,” sebagaimana kritikus
menyebutnya, adalah seekor babi yang telah diubah secara genetik untuk mencerna
dan memproses fosfor dengan lebih baik. Kotoran babi kaya akan phytate, salah
satu bentuk fosfor, sehingga ketika para petani menggunakan kotoran babi
tersebut sebagai pupuk, maka zat kimia tersebut akan hanyut bersama air dan
menyebabkan ganggang berkembang biak hingga bisa menghabiskan oksigen di dalam
air dan bisa membunuh kehidupan laut. Jadi para ilmuwan menambahkan bakteri E.
Coli dan DNA tikus pada embrio seekor babi. Modifikasi ini bisa mengurangi
keluaran fosfor dari seekor babi hingga sebanyak 70 persen—sehingga membuat
babi tersebut menjadi lebih ramah
lingkungan (Hossein, 2009).
e.
Ikan Salmon yang
Cepat Besar e
Ikan salmon milik AquaBounty yang dimodifikasi
secara genetik tumbuh dua kali lipat lebih cepat dibandingkan ikan salmon
varietas konvensional. Perusahaan tersebut mengatakan ikan tersebut mempunyai
rasa, warna, dan bau yang sama, dengan ikan salmon biasa; akan tetapi,
perdebatan masih berlanjut tentang apakah ikan tersebut aman dimakan. Ikan
salmon Atlantik yang direkayasa secara genetik mempunyai hormon pertumbuhan
tambahan yang berasal dari ikan salmon Chinook sehingga memungkinkan ikan
tersebut memproduksi hormon pertumbuhan sepanjang tahun.
Para ilmuwan mampu membuat hormon tersebut tetap
aktif dengan cara menggunakan sebuah gen yang berasal dari seekor ikan yang
menyerupai belut yang dinamakan ocean pout, yang berfungsi sebagai sebuah
“saklar” bagi hormon tersebut. Jika FDA menyetujui penjualan ikan salmon
tersebut, maka ini akan menjadi kali pertamanya pemerintah mengijinkan hewan
yang dimodifikasi dipasarkan untuk konsumsi manusia. Menurut pedoman pemerintah
federal, ikan tersebut tidak akan diberi label sebagai ikan yang dimodifikasi
secara genetic (Hossein, 2009).
f.
Kambing Pembuat
Jaring Laba-Laba
Serat
laba-laba yang kuat dan fleksibel adalah salah satu material yang paling
berharga di alam, dan bisa digunakan untuk menciptakan serangkaian produk mulai
dari ligamen buatan hingga tali parasut (parachute cords) jika saja kita bisa
memproduksinya dalam skala komersial. Pada tahun 2000, Nexia Biotechnologies
mengumumkan bahwa mereka telah mendapatkan jawabannya: seekor kambing yang bisa
memproduksi jaring laba-laba dalam susunya.Para peneliti memasukkan gen sutera
pembuat jaring dari seekor laba-laba ke dalam DNA kambing tersebut dengan cara
sedemikian rupa sehingga kambing tersebut akan memproduksi protein sutera
tersebut hanya di dalam susu mereka. “Susu sutera” ini kemudian bisa digunakan
untuk membuat material seperti jaring yang disebut Biosteel (Hossein, 2009).
DAFTAR
PUSTAKA
Hossein
Azadi. 2009. Genetically Modified and Organic Crops in Developing Countries : A review of Options for Food Security. Sl
: Elsevier Inc.
Miguel,
A., Sosa, G., Gasperi, R.D., Elder, G.A. 2010. Animal transgenesis: an
overview. Brain Struct. Funct. 214:
91-109.
Schoenbaum,
J Thomas. 2001. International Trade in Living Modified Organism, Edited by Francioni, Francesco, “Environment
Human Rights and International Trade”. Oxford: Portland. Hlm. 27.
Sutarno.
2016. Rekayasa genetik dan perkembangan bioteknologi di bidang perternakan. Seminar nasional XIII pendidikan biologi FKIP
UNS 2016. 13 (2) : 23-27
Wall,
R., Laible, G., Maga, E., Seidel, Jr., G. and Whitelaw, B. 2009. Animal
Productivity and
Genetic Diversity:
Cloned and Transgenic Animals. CAST Issue Paper 43 part 8 Animal Agriculture’s Future through
Biotechnology.